LES EFFETS BENEFIQUES & NEGATIFS DES RADICAUX LIBRES (ROS).
Les radicaux libres sont connus pour être responsable du vieillissement cutané et sont liés aux maladies neurodégénératives mais ils sont également essentiels pour combattre les bactéries et les micro-organismes au quotidien.
Alors me direz-vous, si ils sont également essentiels à notre bien-être pourquoi faut-il les combattre ?
La société dans laquelle nous vivons n'est plus celle que nos grands parents ont connu. L'air polluée que nous respirons, l'eau chlorée qui est oxydante (eau du robinet, eau de la piscine...) les boissons gazeuses et l'alimentation..., regroupe dans ce que l'on appel, le stress-oxydatif est en augmentation.
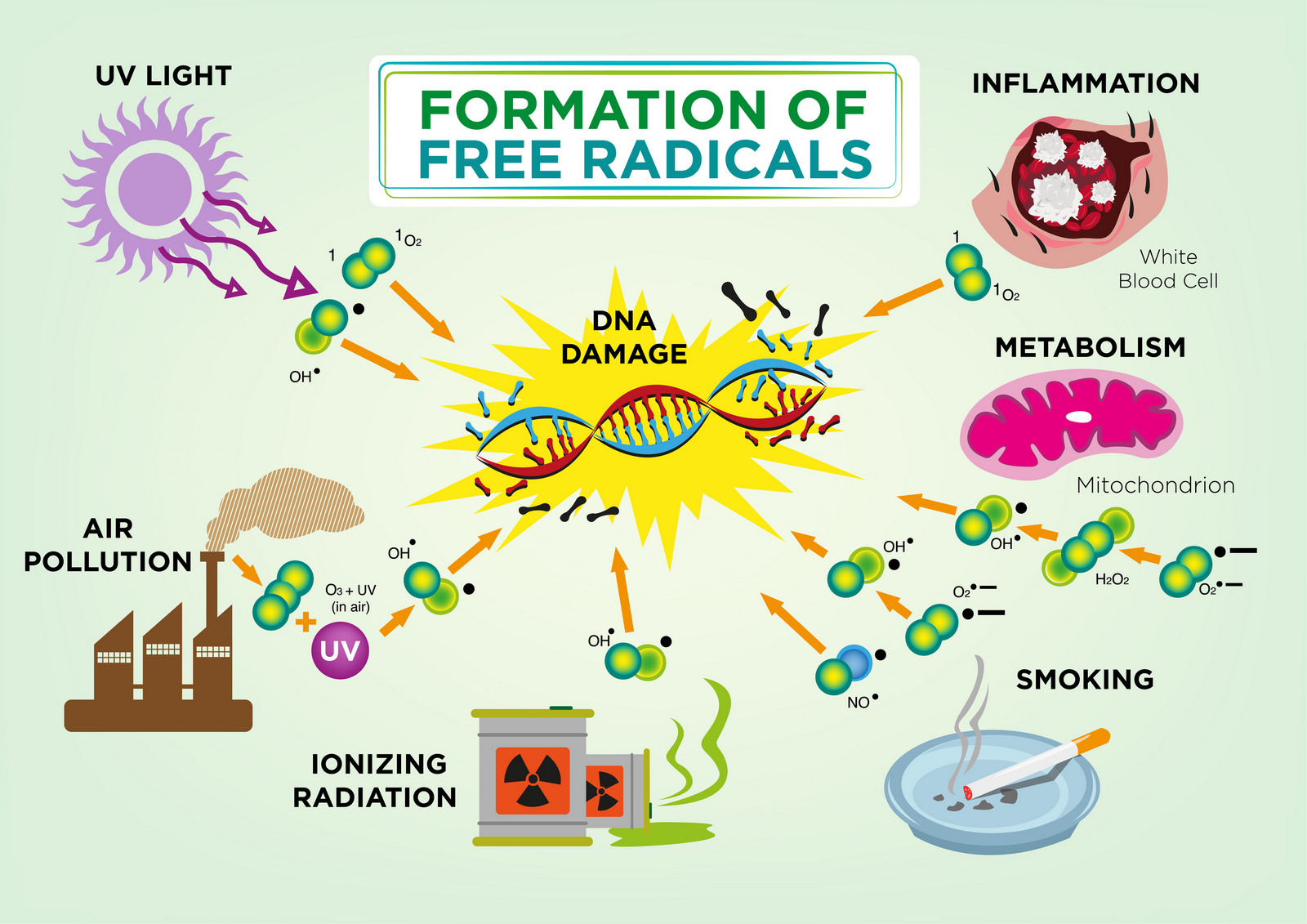
Comment sont produits les ROS ?
Les espèces réactives de l'oxygène ou ROS sont des produits biologiques du métabolisme qui exercent des effets à la fois positifs et négatifs sur le corps. Les ROS comprennent des radicaux libres comme le radical hydroxyle (OH·.), un radical (O2-), l'anion superoxyde oxyde nitrique (NO·), etc1 ainsi que d'autres oxydants (par exemple, le peroxyde d' hydrogène (H2O2), le peroxynitrite (ONOO-) l'oxygène singulet (1O2) ,etc.).2
la principale source de formation des ROS se fait via le complexe lié à la membrane de la NADPH oxydase enzyme et la chaîne de transport d'électrons (principalement complexe 1 et 3 ) de la mitochondrie3 au cours du métabolisme aérobie.
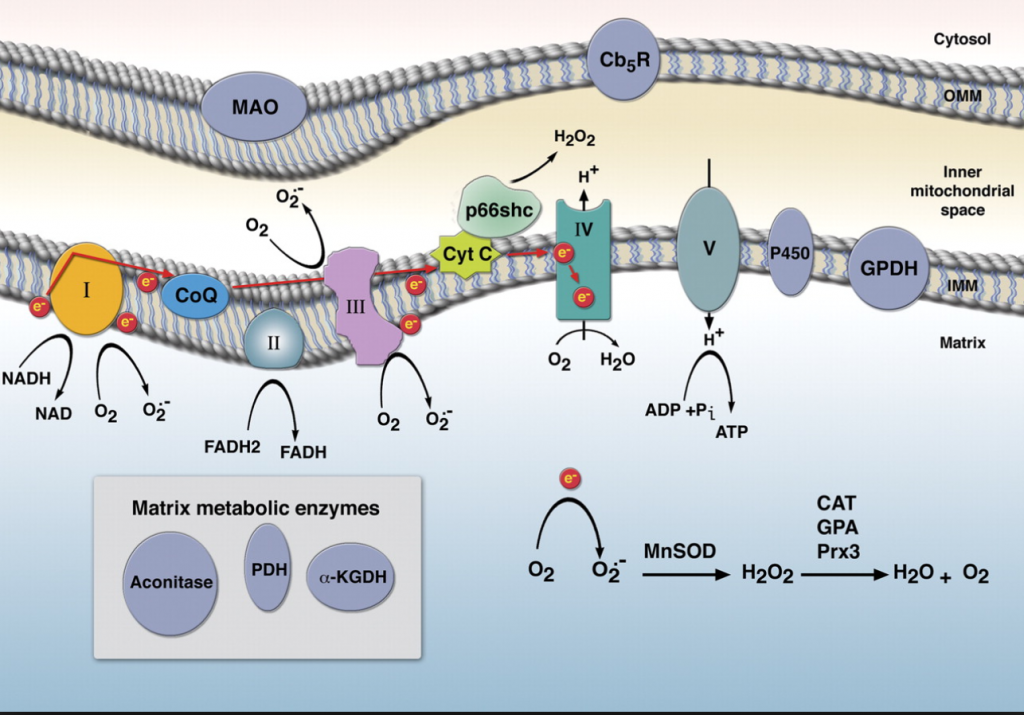
Les effets négatifs des ROS (stress oxydatif ou oxydant)
De nombreux articles traitent des conséquences négatives des ROS et leurs implications sur pratiquement toutes les maladies : troubles immunitaires, comme le diabète sucré4, sclérose en plaques5, l'asthme6, polyarthrite rhumatoïde7, inflammation chronique8, et d'autres maladies mortelles telles que les maladies cardiovasculaires9-10, le cancer11, les maladies neurodégénératives telles que la maladie d'Alzheimer12 et de la maladie de Parkinson13 ainsi que du vieillissement14,15 (peut-être en raison du raccourcissement des télomères16).
Les effets positives des ROS.
Une compréhension plus récente des ROS17-20 démontre que même si elles peuvent avoir des effets secondaires négatifs à des niveaux élevés , elles sont aussi importantes comme molécules de signalisation biologique qui exercent des effets thérapeutiques et de protection contre les maladies , et de jouer un rôle central dans la médiation des avantages lors d'exercises21.
La figure ci-dessus illustre la production de ROS dans les mitochondries et son implication dans la transduction des signaux cellulaires.
Mécanisme de protection du corps.
Étant donné que des niveaux élevés de ROS sont fortement impliqués dans la progression et la pathogenèse de la maladie, nos corps ont la capacité de piéger les ROS après qu'ils exercent leurs effets bénéfiques. Par exemple, la mitochondrie produit le superoxyde qui se dismute en peroxyde d'hydrogène par la superoxyde dismutase, qui est ensuite réduit à l'eau par l'intermédiaire de la glutathion peroxydase / réductases / NADPH system22. Le corps utilise également la catalase, le glutathion, vitamines A, C, E , etc. pour aider à protéger contre les dommages ROS induit.
STRESS REDUCTEUR ET STRESS OXYDANT
Il y a deux forces opposées dans les systèmes biologiques : le stress oxydatif et le stress réducteur. le stress réducteur est atteint lorsque la concentration des agents réducteurs dépasse celle des agents oxydants. Cela se voit dans le métabolisme de l'éthanol (à savoir les ratios élevés de NADH / NAD + et NADPH / NADP + )23. Le stress réducteur peuvent aussi expliquer en partie pourquoi des doses élevées d'antioxydants classiques peuvent augmenter les maladies cardiovasculaires24, cancer25 et la mortalié26. Le vieillissement a récemment été liée à une perte de potentiel du réticulum endoplasmique, ce qui altère le repliement des protéines d'oxydation ; alors, le cytosol devient plus oxydant . Ainsi, il est possible d'avoir un stress réducteur dans un système, et un stress oxydatif dans un autre.
Le stress oxydatif est défini comme lorsque la formation et la concentration de ROS dépasse l'activité endogène d’auto-défense d’antioxydants de l'organisme27. Le stress oxydatif est corrélé avec le vieillissement et le régime alimentaire standard américain. Fait intéressant, l'exercice augmente considérablement les niveaux de ROS et le stress oxydatif en conséquent28. Donc, on peut conclure que l'exercice a des effets secondaires négatifs pour la santé ; cependant, il est bien connu que l'exercice exerce ses effets thérapeutiques et protecteurs puissants29. La recherche a démontré que l'une des raisons pour lesquelles l'exercice régulier exerce ces effets thérapeutiques est parce qu'il régule l'activité antioxydante endogène de l'organisme, ce qui réduit le risque absolu de lésions cellulaires par le stress oxydatif30.
Les antioxydants peuvent annuler les avantages des exercices (sport)
En outre , la formation de ROS induite par l'exercice améliore la sensibilité à l'insuline par l'intermédiaire de co-activateurs de transcription ROS- dépendantes PGC1α et PGC1β , et le facteur de transcription PPARy , qui sont liées au diabète31. Cependant, la voie est bloquée par l'ingestion de quantités élevées d'antioxydants classiques vitamine C et E 32. Le ROS lié au PPARy, PGC1α et PGC1β conduisent à une augmentation de l'expression des enzymes ROS- détoxifiantes, y compris SOD1, SOD2 et GPx1 offrant ainsi une protection accrue contre les diverses maladies qui découlent de stress oxydatif.
On ne sait pas la fréquence, la durée ou l'intensité d'exercice nécessaire pour réguler à la hausse l'expression de ces enzymes antioxydantes endogènes à un tel degré qui offrira des effets protecteurs contre l'oxydation. Cependant, la littérature, fait faire la lumière sur les effets d'une seule période d'exercice par rapport à l'exercice régulier.
Un seul épisode d'exercice augmente les niveaux de ROS et les espèces réactives de l'azote. Cette augmentation conduit à des dommages oxydatifs aiguë et une plus faible résistance au stress oxydatif. Fonction physiologique diminue également ; Cependant, l'activité d'antioxydant endogène, augmentation des enzymes et avec une augmentation possible des mécanismes de réparation de l'oxydation.
En revanche, l'exercice régulier est associé à une diminution absolue de ROS et les espèces réactives de l'azote, ainsi que les dommages oxydatifs inférieur. En outre, la fonction physiologique, la résistance au stress oxydatif, les mécanismes de réparation d'oxydation, et l'activité des antioxydants endogènes, augmentent avec l'exercice régulier.
Sources :
- Bayr, H. (2005). Reactive oxygen species. Critical care medicine, 33(12), S498-S501.
- Turrens, J. F. (2003). Mitochondrial formation of reactive oxygen species. The Journal of physiology, 552(2), 335-344.
- Muller, F. L., Lustgarten, M. S., Jang, Y., Richardson, A. and Van Remmen, H. (2007). "Trends in oxidative aging theories.". Free Radic. Biol. Med. 43 (4): 477–503.
- Houstis, N., Rosen, E. D., & Lander, E. S. (2006). Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature, 440(7086), 944-948.
- LeVine, S. M. (1992). The role of reactive oxygen species in the pathogenesis of multiple sclerosis. Medical hypotheses, 39(3), 271-274.
- Henricks, P. A., & Nijkamp, F. P. (2001). Reactive oxygen species as mediators in asthma. Pulmonary pharmacology & therapeutics, 14(6), 409-420.
- Bauerova, K., & Bezek, S. (2000). Role of reactive oxygen and nitrogen species in etiopathogenesis of rheumatoid arthritis. General Physiology and Biophysics, 18, 15-20.
- Grisham, M. B., Jourd'Heuil, D., & Wink, D. A. (2008). Review article: chronic inflammation and reactive oxygen and nitrogen metabolism–implications in DNA damage and mutagenesis. Alimentary pharmacology & therapeutics, 14(s1), 3-9.
- Abe, J. I., & Berk, B. C. (1998). Reactive oxygen species as mediators of signal transduction in cardiovascular disease. Trends in cardiovascular medicine, 8(2), 59-64.
- Watson, T., Goon, P. K., & Lip, G. Y. (2008). Endothelial progenitor cells, endothelial dysfunction, inflammation, and oxidative stress in hypertension. Antioxidants & redox signaling, 10(6), 1079-1088.
- Cerutti, P. A., & Trump, B. F. (1991). Inflammation and oxidative stress in carcinogenesis. Cancer cells (Cold Spring Harbor, NY: 1989), 3(1), 1.
- Poh Loh, K., Hong Huang, S., De Silva, R., Tan, H., Benny, K., & Zhun Zhu, Y. (2006). Oxidative stress: apoptosis in neuronal injury. Current Alzheimer Research, 3(4), 327-337.
- Nunomura, A., Moreira, P. I., Takeda, A., Smith, M. A., & Perry, G. (2007). Oxidative RNA damage and neurodegeneration. Current medicinal chemistry, 14(28), 2968-2975.
- Harman, D. (1981). The aging process. Proceedings of the National Academy of Sciences, 78(11), 7124-7128.
- Finkel, T., & Holbrook, N. J. (2000). Oxidants, oxidative stress and the biology of ageing. NATURE-LONDON-, 239-247.
- Harman, D. (2003). The free radical theory of aging. Antioxidants and Redox Signaling, 5(5), 557-561.
- Forman, H. J., Maiorino, M., & Ursini, F. (2010). Signaling functions of reactive oxygen species. Biochemistry, 49(5), 835-842.
- Finkel, T. (2011). Signal transduction by reactive oxygen species. The Journal of cell biology, 194(1), 7-15.
- Brosché, M., Overmyer, K., Wrzaczek, M., Kangasjärvi, J., & Kangasjärvi, S. (2010). Stress signaling III: Reactive oxygen species (ROS). Abiotic Stress Adaptation in Plants, 91-102.
- Mittler, R., Vanderauwera, S., Suzuki, N., Miller, G., Tognetti, V. B., Vandepoele, K., ... & Van Breusegem, F. (2011). ROS signaling: the new wave?. Trends in plant science, 16(6), 300-309.
- Powers, S. K., Duarte, J., Kavazis, A. N., & Talbert, E. E. (2010). Reactive oxygen species are signalling molecules for skeletal muscle adaptation. Experimental physiology, 95(1), 1-9.
- Gutteridge, J. (1985). Superoxide dismutase inhibits the superoxide-driven Fenton reaction at two different levels: Implications for a wider protective role. FEBS letters, 185(1), 19-23.
- Cederbaum, A. I., Lu, Y., & Wu, D. (2009). Role of oxidative stress in alcohol-induced liver injury. Archives of toxicology, 83(6), 519-548.
- Lonn, E., Bosch, J., Yusuf, S., Sheridan, P., Pogue, J., Arnold, J. M., ... & Dagenais, G. R. (2005). Effects of long-term vitamin E supplementation on cardiovascular events and cancer: a randomized controlled trial. JAMA: the journal of the American Medical Association, 293(11), 1338.
- Klein, E. A., Thompson Jr, I. M., Tangen, C. M., Crowley, J. J., Lucia, M. S., Goodman, P. J., ... & Baker, L. H. (2011). Vitamin E and the risk of prostate cancer. JAMA: the journal of the American Medical Association, 306(14), 1549-1556.
- Miller 3rd, E. R., Pastor-Barriuso, R., Dalal, D., Riemersma, R. A., Appel, L. J., & Guallar, E. (2005). Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. Annals of internal medicine, 142(1), 37.
- Chrissobolis, S., Miller, A. A., Drummond, G. R., Kemp-Harper, B. K., & Sobey, C. G. (2011). Oxidative stress and endothelial dysfunction in cerebrovascular disease. Frontiers in bioscience: a journal and virtual library, 16, 1733.
- Alessio, H. M., Hagerman, A. E., Fulkerson, B. K., Ambrose, J. E. S. S. I. C. A., Rice, R. E., & Wiley, R. L. (2000). Generation of reactive oxygen species after exhaustive aerobic and isometric exercise. Medicine and science in sports and exercise, 32(9), 1576.
- Elward, K., & Larson, E. B. (1992). Benefits of exercise for older adults. A review of existing evidence and current recommendations for the general population. Clinics in geriatric medicine, 8(1), 35.
- Powers, S. K., Ji, L. L., & Leeuwenburgh, C. H. R. I. S. T. I. A. A. N. (1999). Exercise training-induced alterations in skeletal muscle antioxidant capacity: a brief review. Medicine and science in sports and exercise, 31(7), 987.
- Patti ME, et al. Coordinated reduction of genes of oxidative metabolism in humans with insulin resistance and diabetes: Potential role of PGC1 and NRF1. Proc Natl Acad Sci USA. 2003;100:8466–8471.
- Ristow, M., Zarse, K., Oberbach, A., Klöting, N., Birringer, M., Kiehntopf, M., ... & Blüher, M. (2009). Antioxidants prevent health-promoting effects of physical exercise in humans. Proceedings of the National Academy of Sciences, 106(21), 8665-8670.
- Davies, K. J.; Quintanilha, A. T.; Brooks, G. A.; Packer, L. Free radicals and tissue damage produced by exercise. Biochem. Biophys. Res. Commun. 107:1198–1205; 1982.
- Radak, Z.; Taylor, A. W.; Ohno, H.; Goto, S. Adaptation to exerciseinduced oxidative stress: from muscle to brain. Exerc. Immunol. Rev. 7:90–107; 2001.
- Radak, Z.; Pucsok, J.; Mecseki, S.; Csont, T.; Ferdinandy, P. Muscle soreness-induced reduction in force generation is accompanied by increased nitric oxide content and DNA damage in human skeletal muscle. Free Radic. Biol. Med. 26:1059–1063; 1999.
- Radak, Z.; Asano, K.; Inoue, M.; Kizaki, T.; Oh-Ishi, S.; Suzuki, K.; Taniguchi, N.; Ohno, H. Superoxide dismutase derivative reduces oxidative damage in skeletal muscle of rats during exhaustive exercise. J. Appl. Physiol. 79:129–135; 1995.
- Radak, Z.; Asano, K.; Inoue, M.; Kizaki, T.; Oh-Ishi, S.; Suzuki, K.; Taniguchi, N.; Ohno, H. Superoxide dismutase derivative prevents oxidative damage in liver and kidney of rats induced by exhausting exercise. Eur. J. Appl. Physiol. Occup. Physiol. 72:189–194; 1996.
- Radak, Z.; Apor, P.; Pucsok, J.; Berkes, I.; Ogonovszky, H.; Pavlik, G.; Nakamoto, H.; Goto, S. Marathon running alters the DNA base excision repair in human skeletal muscle. Life Sci. 72:1627–1633; 2003.
- Radak, Z.; Sasvari, M.; Nyakas, C.; Kaneko, T.; Tahara, S.; Nakamoto, H.; Goto, S. Single bout of exercise eliminates the immobilization-induced oxidative stress rat brain. Neurochem. Int. 39:33–38; 2001.
- Radak, Z.; Chung, H. Y.; Naito, H.; Takahashi, R.; Jung, K. J.; Kim, H. J.; Goto, S. Age-associated increase in oxidative stress and nuclear factor kappaB activation are attenuated in rat liver by regular exercise. FASEB J. 18:749–750; 2004.
- Alessio, H. M.; Goldfarb, A. H. Lipid peroxidation and scavenger enzymes during exercise: adaptive response to training. J. Appl. Physiol. 64:1333–1336; 1988.
- Radak, Z.; Kaneko, T.; Tahara, S.; Nakamoto, H.; Ohno, H.; Sasvari, M.; Nyakas, C.; Goto, S. The effect of exercise training on oxidative damage of lipids, proteins, and DNA in rat skeletal muscle: evidence for beneficial outcomes. Free Radic. Biol. Med. 27:69–74; 1999.
- Radak, Z.; Sasvari, M.; Nyakas, C.; Pucsok, J.; Nakamoto, H.; Goto, S. Exercise preconditioning against hydrogen peroxide induced oxidative damage in proteins of rat myocardium. Arch. Biochem. Biophys. 376: 248–251; 2000.
- Cotman, C. W.; Engesser-Cesar, C. Exercise enhances and protects brain function. Exerc. Sport Sci. Rev. 30:75–79; 2002.
- Berchtold, N. C.; Chinn, G.; Chou, M.; Kesslak, J. P.; Cotman, C. W. Exercise primes a molecular memory for brain-derived neurotrophic factor protein induction in the rat hippocampus. Neuroscience 133:853–861; 2005
- Radak, Z.; Kaneko, T.; Tahara, S.; Nakamoto, H.; Sasvari, M.; Nyakas, C.; Goto, S. Regular exercise improves cognitive function and decreases oxidative damage in rat brain. Neurochem. Int. 38:17–23; 2001.
- Vaynman, S.; Ying, Z.; Gomez-Pinilla, F. Interplay between brain-derived neurotrophic factor and signal transduction modulators in the regulation of the effects of exercise on synaptic-plasticity. Neuroscience 122:647–657; 2003.
- Van Praag, H.; Kempermann, G.; Gage, F. H. Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nat. Neurosci. 2:266–270; 1999.
- Van Praag, H.; Christie, B. R.; Sejnowski, T. J.; Gage, F. H. Running enhances neurogenesis, learning, and long-term potentiation in mice. Proc. Natl. Acad. Sci. USA 96:13427–13431; 1999.
- Adlard, P. A.; Cotman, C. W. Voluntary exercise protects against stressinduced decreases in brain-derived neurotrophic factor protein expression. Neuroscience 124:985–992; 2004.
- Radak, Z.; Toldy, A.; Szabo, Z.; Siamilis, S.; Nyakas, C.; Silye, G.; Jakus, J.; Goto, S. The effects of training and detraining on memory, neurotrophins and oxidative stress markers in rat brain. Neurochem. Int. 49:387–392; 2006.
- Ushio-Fukai, M.; Alexander, R. W. Reactive oxygen species as mediators of angiogenesis signaling: role of NAD(P)H oxidase. Mol. Cell. Biochem. 264:85–97; 2004.
- Radak, Z.; Naito, H.; Kaneko, T.; Tahara, S.; Nakamoto, H.; Takahashi, R.; Cardozo-Pelaez, F.; Goto, S. Exercise training decreases DNA damage and increases DNA repair and resistance against oxidative stress of proteins in aged rat skeletal muscle. Pflugers Arch. 445:273–278; 2002.
- Nakamoto, H., Kaneko, T., Tahara, S., Hayashi, E., Naito, H., Radak, Z., & Goto, S. (2007). Regular exercise reduces 8-oxodG in the nuclear and mitochondrial DNA and modulates the DNA repair activity in the liver of old rats. Experimental gerontology, 42(4), 287-295.
- OHSAWA, I., ISHIKAWA, M., TAKAHASHI, K., WATANABE, M., NISHIMAKI, K., YAMAGATA, K., KATSURA, K., KATAYAMA, Y., ASOH, S. & OHTA, S. (2007). Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals. Nat Med 13, 688-694.
. Traduction du site http://www.molecularhydrogenfoundation.org/
