Toutes les informations ci-dessous ne doivent pas remplacer ou arrêter votre traitement ou bien remplacer les conseils de votre médecin
Abstrait (L'hydrogène gazeux dans le traitement du cancer)
Les molécules de signalisation de gaz (GSM), composées d'oxygène, de monoxyde de carbone, d'oxyde nitrique, de sulfure d'hydrogène, etc., jouent un rôle essentiel dans la régulation de la transduction du signal et de l'homéostasie cellulaire. Fait intéressant, à travers diverses administrations, ces molécules présentent également un potentiel dans le traitement du cancer.
Récemment, l'hydrogène gazeux (formule: H2) émerge comme un autre GSM qui possède de multiples bioactivités, y compris des espèces anti-inflammatoires, anti-réactives de l'oxygène et anti-cancer. De plus en plus de preuves ont montré que l'hydrogène gazeux peut soit atténuer les effets secondaires causés par les chimiothérapies conventionnelles, soit supprimer la croissance des cellules cancéreuses et des xénogreffes tumorales, ce qui suggère sa large application puissante en thérapie clinique. Dans la revue actuelle, nous résumons ces études et discutons des mécanismes sous-jacents.
L'application de l'hydrogène gazeux dans le traitement du cancer en est encore à ses débuts, une étude mécanique plus approfondie et le développement d'instruments portables sont justifiés.
Introduction
Les molécules de signalisation gazeuses (GSM) font référence à un groupe de molécules gazeuses, telles que l'oxygène (1), l'oxyde nitrique (2), le monoxyde de carbone (3), le sulfure d'hydrogène (4), le dioxyde de soufre (5, 6), l'éthylène (7) , 8), etc. Ces molécules gazeuses possèdent de multiples fonctions critiques dans la régulation de la biologie cellulaire in vivo via la transduction du signal (9). Plus important encore, certains GSM pourraient servir d'agents thérapeutiques dans le cancer primaire, ainsi que dans le traitement du cancer multirésistant lorsqu'ils sont utilisés directement ou par certaines formulations pharmaceutiques (9–13).
De plus, certains de ces GSM peuvent être générés dans le corps via différentes bactéries ou enzymes, telles que l'oxyde nitrique, le sulfure d'hydrogène, ce qui indique qu'il s'agit de molécules plus compatibles qui peuvent présenter moins d'effets indésirables par rapport aux chimiothérapies conventionnelles (9, 14, 15) . Récemment, l'hydrogène gazeux a été reconnu comme un autre GSM important en biologie, présentant un potentiel attrayant dans les soins de santé pour son rôle dans la prévention des lésions cellulaires de diverses attaques (16–19).
Avec la formule H2, l'hydrogène gazeux est la molécule la plus légère de la nature qui ne représente qu'environ 0,5 partie par million (ppm) de tout le gaz. Naturellement, l'hydrogène gazeux est un gaz incolore, inodore, insipide, non toxique et hautement combustible qui peut former des mélanges explosifs avec l'air à des concentrations de 4 à 74% pouvant être déclenchées par une étincelle, la chaleur ou la lumière du soleil. L'hydrogène gazeux peut être généré en petite quantité par l'hydrogénase de certains membres du microbiote du tractus gastro-intestinal humain à partir des glucides non absorbés dans l'intestin par dégradation et métabolisme (20, 21), qui est ensuite partiellement diffusé dans le flux sanguin et libéré et détecté dans l'air expiré (20), indiquant son potentiel à servir de biomarqueur.
En tant que molécule la plus légère du naturel, l'hydrogène gazeux présente une propriété de pénétration attrayante, car il peut se diffuser rapidement à travers les membranes cellulaires (22, 23). Une étude sur un modèle animal a montré qu'après administration orale d'eau super-riche en hydrogène (HSRW) et administration intra-péritonéale de solution saline super-riche en hydrogène (HSRS), la concentration en hydrogène a atteint le pic à 5 min; alors qu'il a fallu 1 min par administration intraveineuse de HSRS (23).
Une autre étude in vivo a testé la distribution de l'hydrogène dans le cerveau, le foie, les reins, la graisse du mésentère et le muscle de la cuisse chez le rat lors de l'inhalation de 3% d'hydrogène gazeux (24). L'ordre de concentration de l'hydrogène gazeux, une fois atteint l'état saturé, était le foie, le cerveau, le mésentère, les muscles, les reins, indiquant diverses distributions parmi les organes chez le rat. Sauf que le muscle de la cuisse a mis plus de temps à se saturer, les autres organes ont besoin de 5 à 10 minutes pour atteindre la Cmax (concentration maximale d'hydrogène). Pendant ce temps, le foie avait la Cmax la plus élevée (24). Les informations peuvent orienter l'application clinique future de l'hydrogène gazeux.
Bien que l'hydrogène gazeux ait été étudié comme thérapie dans un modèle de souris carcinome épidermoïde de la peau en 1975 (25), son potentiel d'application médicale n'a pas été largement exploré avant 2007, lorsque Oshawa et al. ont rapporté que l'hydrogène pouvait améliorer les lésions d'ischémie-reperfusion cérébrale en réduisant sélectivement les espèces cytotoxiques réactives de l'oxygène (ROS), y compris le radical hydroxyle (• OH) et le péroxynitrite (ONOO-) (26), ce qui a ensuite suscité une attention mondiale. Selon diverses formulations administratives, l'hydrogène gazeux a été utilisé comme agent thérapeutique pour une variété de maladies, telles que la maladie de Parkinson (27, 28), la polyarthrite rhumatoïde (29), les lésions cérébrales (30), les lésions de reperfusion ischémique (31, 32) et diabète (33, 34), etc.
Plus important encore, il a été démontré que l'hydrogène améliorait les paramètres cliniques et les marqueurs de substitution, des maladies métaboliques aux troubles inflammatoires systémiques chroniques en passant par le cancer (17). Une étude clinique en 2016 a montré que l'inhalation d'hydrogène gazeux était sans danger chez les patients atteints du syndrome post-arrêt cardiaque (35), son application thérapeutique supplémentaire dans d'autres maladies est devenue encore plus attrayante.
Dans la revue actuelle, nous nous intéressons à son application dans le traitement du cancer. En règle générale, l'hydrogène gazeux peut exercer ses bio-fonctions via la régulation des ROS, des événements d'inflammation et d'apoptose.
L'hydrogène gazeux élimine sélectivement les radicaux hydroxyle et le péroxynitrite, et régule certaines enzymes antioxydantes
De loin, de nombreuses études ont indiqué que l'hydrogène gazeux ne cible pas des protéines spécifiques, mais régule plusieurs acteurs clés du cancer, y compris les ROS, et certaines enzymes antioxydantes (36).
ROS fait référence à une série de molécules instables contenant de l'oxygène, y compris l'oxygène singulet (O2 •), le peroxyde d'hydrogène (H2O2), le radical hydroxyle (• OH), le superoxyde (∙ O − 2), l'oxyde nitrique (NO •) et le péroxynitrite (ONOO-), etc. (37, 38). Une fois générés in vivo, en raison de leur forte réactivité, les ROS peuvent attaquer les protéines, l'ADN / ARN et les lipides des cellules, provoquant des dommages distincts pouvant conduire à l'apoptose. La présence de ROS peut produire un stress et des dommages cellulaires pouvant entraîner la mort cellulaire, via un mécanisme connu sous le nom de stress oxydatif (39, 40).
Normalement, sous condition physique, les cellules, y compris les cellules cancéreuses, maintiennent un équilibre entre la génération et l'élimination des ROS, ce qui est d'une importance capitale pour leur survie (41, 42). Le ROS surproduit, résultant d'un système de régulation du déséquilibre ou d'une attaque chimique externe (y compris la chimiothérapie / radiothérapie), peut déclencher une cascade d'apoptose interne, provoquant des effets extrêmement toxiques (43–45).
L'hydrogène gazeux peut agir comme un modulateur ROS. Premièrement, comme le montre l'étude d'Ohsawa et al., L'hydrogène gazeux pourrait piéger sélectivement les ROS les plus cytotoxiques, • OH, comme testé dans un modèle de rat aigu d'ischémie cérébrale et de reperfusion (26). Une autre étude a également confirmé que l'hydrogène gazeux pouvait réduire la toxicité de l'oxygène résultant de l'oxygène hyperbare en réduisant efficacement • OH (46).
Deuxièmement, l'hydrogène peut induire l'expression de certaines enzymes antioxydantes qui peuvent éliminer les ROS, et il joue un rôle clé dans la régulation de l'homéostasie redox des cellules cancéreuses (42, 47). Des études ont indiqué que lors du traitement de l'hydrogène gazeux, l'expression de la superoxyde dismutase (SOD) (48), de l'hème oxyganase-1 (HO-1) (49), ainsi que du facteur nucléaire érythroïde 2 lié au facteur 2 (Nrf2) (50 ), a augmenté de manière significative, renforçant son potentiel d'élimination des ROS.
En régulant les ROS, l'hydrogène gazeux peut agir comme un régime adjuvant pour réduire les effets indésirables du traitement du cancer tout en n'abolissant pas la cytotoxicité d'autres thérapies, telles que la radiothérapie et la chimiothérapie (48, 51). Fait intéressant, en raison de la sur-production de ROS dans les cellules cancéreuses (38), l'administration d'hydrogène gazeux peut abaisser le niveau de ROS au début, mais elle provoque beaucoup plus de production de ROS en raison de l'effet de compensation, conduisant à la mort des cellules cancéreuses. (52).
L'hydrogène gazeux supprime les cytokines inflammatoires
Les cytokines inflammatoires sont une série de molécules signal qui interviennent dans la réponse immunitaire innée, dont la dysrégulation peut contribuer à de nombreuses maladies, y compris le cancer (53–55). Les cytokines inflammatoires typiques comprennent les interleukines (IL) excrétées par les globules blancs, les facteurs de nécrose tumorale (TNF) excrétés par les macrophages, qui ont tous deux montré un lien étroit avec l'initiation et la progression du cancer (56-59), et les IL et les TNF peuvent être supprimé par l'hydrogène gazeux (60, 61).
L'inflammation induite par la chimiothérapie chez les patients cancéreux provoque non seulement des effets indésirables graves (62, 63), mais entraîne également des métastases cancéreuses et un échec du traitement (64, 65). En régulant l'inflammation, l'hydrogène gazeux peut empêcher la formation et la progression des tumeurs, ainsi que réduire les effets secondaires causés par la chimiothérapie / radiothérapie (66).
L'hydrogène gazeux inhibe / induit l'apoptose
L'apoptose, également appelée mort cellulaire programmée, peut être déclenchée par des signaux extrinsèques ou intrinsèques et exécutée par différentes voies moléculaires, qui constituent une stratégie efficace pour le traitement du cancer (67, 68). En général, l'apoptose peut être induite en (1) provoquant les récepteurs de mort de la surface cellulaire (tels que Fas, les récepteurs du TNF ou le ligand induisant l'apoptose lié au TNF), (2) en supprimant la signalisation de survie (comme le récepteur du facteur de croissance épidermique, protéine kinase activée par un mitogène, ou phosphoinositide 3-kinases), et (3) activant les protéines de la famille pro-apoptotique du lymphome à cellules B-2 (Bcl-2), ou régulant à la baisse les protéines anti-apoptose (telles que les protéines liées à l'X) inhibiteur de la protéine d'apoptose, survivante et inhibiteur de l'apoptose) (69, 70).
L'hydrogène gazeux peut réguler l'apoptose intracellulaire en affectant l'expression des enzymes liées à l'apoptose. À une certaine concentration, il peut servir d'agent inhibiteur de l'apoptose en inhibant la protéine X associée au lymphome B pro-apoptotique (Bax), la caspase-3, 8, 12, et en améliorant la cellule B anti-apoptotique. lymphome-2 (Bcl-2) (71), ou comme agent induisant l'apoptose via les mécanismes de contraste (72), suggérant son potentiel à protéger les cellules normales contre les médicaments anticancéreux ou à supprimer les cellules cancéreuses.
L'hydrogène gazeux présente un potentiel dans le traitement du cancer
L'hydrogène gazeux atténue les effets indésirables liés à la chimiothérapie / radiothérapie
La chimiothérapie et la radiothérapie restent les principales stratégies de traitement du cancer (73, 74). Cependant, les patients cancéreux recevant ces traitements éprouvent souvent de la fatigue et une qualité de vie altérée (75–77). On pense que la génération en flèche de ROS pendant le traitement contribue aux effets indésirables, entraînant un stress oxydatif et une inflammation remarquables (41, 42, 78). Par conséquent, bénéficiant de ses propriétés anti-oxydantes et anti-inflammatoires et autres propriétés de protection cellulaire, l'hydrogène gazeux peut être adopté comme régime thérapeutique adjuvant pour supprimer ces effets indésirables. Sous traitement par le géfitinib, inhibiteur des récepteurs du facteur de croissance épidermique, les patients atteints d'un cancer du poumon non à petites cellules souffrent souvent d'une pneumonie interstitielle aiguë sévère (79).
Dans un modèle de souris traité par administration orale de géfitinib et injection intrapéritonéale de naphtalène qui a induit des lésions pulmonaires sévères dues au stress oxydatif, le traitement à l'eau riche en hydrogène a réduit de manière significative les cytokines inflammatoires, telles que l'IL-6 et le TNFα dans le liquide de lavage bronchoalvéolaire pour soulager l'inflammation pulmonaire. Plus important encore, l'eau riche en hydrogène n'a pas altéré les effets anti-tumoraux globaux du géfitinib à la fois in vitro et in vivo, alors qu'en revanche, elle a antagonisé la perte de poids induite par le géfitinib et le naphtalène, et a amélioré le taux de survie global, suggérant l'hydrogène. gaz est un agent adjuvant prometteur qui a le potentiel d'être appliqué dans la pratique clinique pour améliorer la qualité de vie des patients cancéreux (80).
La doxorubicine, un antibiotique anthracycline, est un agent anticancéreux efficace dans le traitement de divers cancers, mais son application est limitée pour la cardiomyopathie dilatée fatale et l'hépatotoxicité (81, 82). Une étude in vivo a montré que l'injection intrapéritonéale de solution saline riche en hydrogène améliorait la mortalité et le dysfonctionnement cardiaque causés par la doxorubicine. Ce traitement a également atténué les changements histopathologiques dans le sérum de rats, tels que les taux sériques de peptide natriurétique cérébral (BNP), d'aspartate transaminase (AST), d'alanine transaminase (ALT), d'albumine et de malondialdéhyde (MDA). Mécanistiquement, une solution saline riche en hydrogène a considérablement abaissé le niveau de ROS, ainsi que les cytokines inflammatoires TNF-α, IL-1β et IL-6 dans les tissus cardiaques et hépatiques. Une solution saline riche en hydrogène a également induit moins d'expression de Bax apoptotique, de caspase-3 clivée et de Bcl-2 anti-apoptotique plus élevée, entraînant moins d'apoptose dans les deux tissus (71).
Cette étude a suggéré que le traitement salin riche en hydrogène exerce ses effets protecteurs en inhibant la voie inflammatoire du TNF-α / IL-6, en augmentant l'expression clivée de C8 et le rapport Bcl-2 / Bax et en atténuant l'apoptose cellulaire dans les tissus cardiaques et hépatiques ( 71).
L'eau riche en hydrogène a également montré un effet de protection rénale contre la néphrotoxicité induite par le cisplatine chez le rat. Dans les études, les images de résonance magnétique (IRM) de contraste dépendant du niveau d'oxygénation sanguine (BOLD) acquises dans différents groupes traités ont montré que les taux de créatinine et d'azote uréique sanguin (BUN), deux paramètres liés à la néphrotoxicité, étaient significativement plus élevés dans le cisplatine traité. groupe que ceux du groupe témoin. Le traitement de l'eau riche en hydrogène pourrait inverser considérablement les effets toxiques, et il a montré un taux de relaxation transversale beaucoup plus élevé en éliminant les radicaux oxygène (83, 84).
Une autre étude a montré que l'inhalation d'hydrogène gazeux (1% d'hydrogène dans l'air) et la consommation d'eau riche en hydrogène (0,8 mM d'hydrogène dans l'eau) pouvaient inverser la mortalité et la perte de poids corporel causées par le cisplatine via sa propriété anti-oxydante. Les deux traitements ont amélioré la métamorphose, accompagnée d'une diminution de l'apoptose rénale et de la néphrotoxicité telle qu'évaluée par les taux de créatinine sérique et de BUN. Plus important encore, l'hydrogène n'a pas altéré l'activité antitumorale du cisplatine contre les lignées cellulaires cancéreuses in vitro et chez les souris porteuses de tumeurs (85). Des résultats similaires ont également été observés dans l'étude de Meng et al., car ils ont montré qu'une solution saline riche en hydrogène pouvait atténuer la libération d'hormone folliculo-stimulante, augmenter le niveau d'œstrogène, améliorer le développement des follicules et réduire les dommages à l'ovaire. cortex induit par le cisplatine. Dans l'étude, le traitement au cisplatine a induit un niveau plus élevé de produits d'oxydation, supprimé l'activité enzymatique antioxydante. L'administration d'une solution saline riche en hydrogène pourrait inverser ces effets toxiques en réduisant la MDA et en restaurant l'activité de la superoxyde dismutase (SOD), catalase (CAT), deux enzymes antioxydantes importantes. En outre, une solution saline riche en hydrogène a stimulé la voie Nrf2 chez les rats atteints de lésions ovariennes (86).
Le régime mFOLFOX6, composé d'acide folinique, de 5-fluorouracile et d'oxaliplatine, est utilisé comme traitement de première intention du cancer colorectal métastatique, mais il confère également des effets toxiques au foie, entraînant une mauvaise qualité de vie du patient (87, 88) . Une étude clinique a été menée en Chine en investissant l'effet protecteur de l'eau riche en hydrogène sur la fonction hépatique de patients atteints d'un cancer colorectal (144 patients ont été recrutés et 136 d'entre eux ont été inclus dans l'analyse finale) traités par chimiothérapie mFOLFOX6. Les résultats ont montré que le groupe placebo présentait des effets néfastes causés par la chimiothérapie mFOLFOX6 tels que mesurés par les niveaux élevés d'ALT, d'AST et de bilirubine indirecte (IBIL), tandis que le groupe de traitement combinatoire en eau riche en hydrogène ne présentait aucune différence dans la fonction hépatique pendant le traitement, probablement en raison de son activité antioxydante, ce qui en fait un agent protecteur prometteur pour soulager les lésions hépatiques liées au mFOLFOX6 (51).
La plupart des effets néfastes des rayonnements ionisants sur les cellules normales sont induits par les radicaux hydroxyles. La combinaison de la radiothérapie avec certaines formes d'hydrogène gazeux peut être bénéfique pour atténuer ces effets secondaires (89). En effet, plusieurs études ont montré que l'hydrogène pouvait protéger les cellules et les souris des radiations (48, 90). Comme testé dans un modèle de rat de lésions cutanées établies en utilisant un faisceau électronique de 44 Gy, le groupe traité par de l'eau riche en hydrogène a présenté un levier plus élevé d'activité SOD et une MDA et IL-6 plus faibles dans les tissus blessés que le groupe témoin et le groupe distillé. groupe d'eau. De plus, l'eau riche en hydrogène a raccourci le temps de guérison et augmenté le taux de guérison des lésions cutanées (48).
La toxicité gastro-intestinale est un effet secondaire fréquent induit par la radiothérapie, qui altère la qualité de vie des patients cancéreux (91). Comme le montre l'étude de Xiao et al.sur le modèle de souris, l'administration d'hydrogène-eau par gavage oral a augmenté le taux de survie et le poids corporel des souris exposées à une irradiation abdominale totale, accompagnée d'une amélioration de la fonction du tractus gastro-intestinal et de l'intégrité épithéliale. de l'intestin grêle. Une analyse plus approfondie des micropuces a révélé que le traitement hydrogène-eau régulait à la hausse miR-1968-5p, qui a ensuite régulé à la hausse son gène de réponse primaire de différenciation myéloïde cible 88 (MyD88, un médiateur en immunopathologie, et la dynamique du microbiote intestinal de certaines maladies intestinales impliquant des comme les récepteurs 9) expression dans l'intestin grêle après irradiation abdominale totale (92).
Une autre étude menée chez des patients cliniques atteints de tumeurs hépatiques malignes a montré que la consommation d'eau riche en hydrogène pendant 6 semaines réduisait le niveau de métabolite réactif de l'oxygène, l'hydroperoxyde, et maintenait l'activité antioxydante biologique dans le sang. Surtout, les scores de qualité de vie pendant la radiothérapie ont été significativement améliorés dans le groupe eau riche en hydrogène par rapport au groupe placebo eau. Les deux groupes ont présenté une réponse tumorale similaire à la radiothérapie, indiquant que la consommation d'eau riche en hydrogène réduisait le stress oxydatif induit par les radiations tout en ne compromettant pas l'effet anti-tumoral de la radiothérapie (93).
L'hydrogène gazeux agit en synergie avec la thermothérapie
Récemment, une étude a révélé que l'hydrogène pouvait améliorer l'effet de la thérapie photothermique. Zhao et coll. a conçu les nanocristaux de Pd hydrogénés (appelés PdH0.2) en tant que vecteur d'hydrogène multifonctionnel pour permettre la délivrance ciblée sur la tumeur (en raison du nanocristal de Pd cubique de 30 nm) et la libération contrôlée d'hydrogène bio-réducteur (en raison de l'hydrogène incorporé dans le réseau de Pd). Comme le montre cette étude, la libération d'hydrogène pourrait être ajustée par la puissance et la durée de l'irradiation dans le proche infrarouge (NIR).
Le traitement des nanocristaux de PdH0.2 plus l'irradiation NIR entraînent une perte initiale plus élevée de ROS dans les cellules cancéreuses, et le rebond ROS ultérieur était également beaucoup plus élevé que celui des cellules normales, entraînant plus d'apoptose et une inhibition sévère du métabolisme mitochondrial dans les cellules cancéreuses, mais cellules normales. La combinaison de nanocristaux de PdH0.2 avec l'irradiation NIR a considérablement amélioré l'efficacité anticancéreuse de la thérapie thermique, obtenant un effet anticancéreux synergique. L'évaluation de l'innocuité in vivo a montré que la dose d'injection de 10 mg kg-1 nanocristaux de PdH0.2 n'a causé aucun décès, aucun changement de plusieurs indicateurs sanguins et aucune fonction affectée du foie et des reins.
Dans le modèle de tumeur de cancer du sein murin 4T1 et le modèle de tumeur de mélanome B16-F10, la thérapie combinée de nanocristaux PdH0.2 et d'irradiation NIR a montré un effet anticancéreux synergique, conduisant à une inhibition de la tumeur remarquable par rapport à la thérapie thermique. Pendant ce temps, le groupe de combinaison n'a montré aucun dommage visible au cœur, au foie, à la rate, aux poumons et aux reins, ce qui indique une sécurité et une compatibilité tissulaires appropriées (52).
L'hydrogène gazeux supprime la formation de tumeurs
Li et coll. ont rapporté que la consommation d'eau riche en hydrogène atténuait les lésions rénales causées par le nitrilotriacétate ferrique (Fe-NTA) chez le rat, comme en témoigne une diminution des taux de créatinine sérique et de BUN. L'eau riche en hydrogène a supprimé le stress oxydatif induit par le Fe-NTA en abaissant la peroxydation lipidique, ONOO−, et en inhibant les activités de la NADPH oxydase et de la xanthine oxydase, ainsi qu'en régulant à la hausse la catalase antioxydante et en restaurant la fonction mitochondriale des reins.
Par conséquent, les cytokines inflammatoires induites par Fe-NTA, telles que NF-kB, IL-6 et monocyte chimioattractant protein-1 ont été considérablement atténuées par le traitement à l'hydrogène. Plus important encore, la consommation d'eau riche en hydrogène a inhibé l'expression de plusieurs protéines liées au cancer, notamment le facteur de croissance de l'endothélium vasculaire (VEGF), le transducteur de signal et l'activateur de la phosphorylation de la transcription 3 (STAT3) et la prolifération de l'antigène nucléaire cellulaire (PCNA) chez le rat, entraînant diminution de l'incidence du carcinome rénal et suppression de la croissance tumorale. Ces travaux ont suggéré que l'eau riche en hydrogène était un régime prometteur pour atténuer les lésions rénales induites par le Fe-NTA et supprimer les événements tumoraux précoces (66). La stéatohépatite non alcoolique (NASH) due au stress oxydatif induit par divers stimuli, est l'une des raisons qui provoquent l'hépatocarcinogenèse (94, 95).
Dans un modèle murin, l'administration d'eau riche en hydrogène a abaissé le cholestérol hépatique, l'expression du récepteur α activé par les proliférateurs de peroxysomes (PPARα) et augmenté les effets anti-oxydants dans le foie par rapport au groupe témoin et traité à la pioglitazone (96). L'eau riche en hydrogène a montré de puissants effets inhibiteurs sur les cytokines inflammatoires TNF-α et IL-6, le stress oxydatif et le biomarqueur de l'apoptose. Comme le montre le modèle d'hépatocarcinogenèse lié à la NASH, dans le groupe de traitement à l'eau riche en hydrogène, l'incidence des tumeurs était plus faible et les volumes de tumeurs étaient plus petits que ceux du groupe témoin et traité par la pioglitazone. Les résultats ci-dessus ont indiqué que l'eau riche en hydrogène avait un potentiel de protection hépatique et de traitement du cancer du foie (96).
L'hydrogène gazeux supprime la croissance tumorale
Non seulement en tant que thérapie adjuvante, l'hydrogène gazeux peut également supprimer la croissance des tumeurs et des cellules tumorales.
Comme le montre l'étude de Wang et al.sur les lignées cellulaires de cancer du poumon A549 et H1975, l'hydrogène gazeux a inhibé la prolifération cellulaire, la migration et l'invasion, et induit une apoptose remarquable comme testé par CCK-8, la cicatrisation des plaies, les dosages transwell et cytométrie en flux. L'hydrogène gazeux a arrêté le cycle cellulaire au stade G2 / M sur les deux lignées cellulaires en inhibant l'expression de plusieurs protéines de régulation du cycle cellulaire, y compris la cycline D1, CDK4 et CDK6. Les chromosomes 3 (SMC3), un complexe nécessaire à la cohésion des chromosomes au cours du cycle cellulaire (97), ont été supprimés par l'hydrogène gazeux via des effets d'ubiquitination. Surtout, une étude in vivo a montré que sous traitement à l'hydrogène gazeux, la croissance tumorale était significativement inhibée, ainsi que l'expression de Ki-67, VEGF et SMC3. Ces données suggèrent que l'hydrogène gazeux pourrait servir de nouvelle méthode pour le traitement du cancer du poumon (98).
En raison de ses caractéristiques physico-chimiques, l'utilisation de l'hydrogène gazeux a été strictement limitée dans les établissements hospitaliers et médicaux et les laboratoires. Li et coll. a conçu une silice d'occlusion d'hydrogène solidifiée (silice H2) qui pourrait libérer de manière stable de l'hydrogène moléculaire dans le milieu de culture cellulaire. La silice H2 pourrait inhiber en fonction de la concentration la viabilité cellulaire des cellules de carcinome épidermoïde de l'œsophage humain (KYSE-70), alors qu'elle a besoin d'une dose plus élevée pour supprimer les cellules épithéliales de l'œsophage humaines normales (HEEpiCs), indiquant son profil sélectif. Cet effet a été confirmé par un test d'apoptose et de migration cellulaire dans ces deux lignées cellulaires. Une étude mécaniste a révélé que la silice H2 exerçait son action anticancéreuse en induisant une accumulation de H2O2, un arrêt du cycle cellulaire et une induction de l'apoptose médiée par des voies apoptotiques mitochondriales (72).
Récemment, on a découvert que l'hydrogène gazeux inhibait les cellules souches cancéreuses (CSC). L'hydrogène gazeux a réduit la formation de colonies et la formation de sphères de cellules cancéreuses ovariennes humaines Hs38.T et PA-1 en inhibant le marqueur de prolifération Ki67, les marqueurs de cellules souches CD34 et l'angiogenèse. Le traitement à l'hydrogène gazeux a inhibé de manière significative la prolifération, l'invasion, la migration des cellules Hs38.T et PA-1. Plus important encore, l'inhalation d'hydrogène gazeux a inhibé le volume de la tumeur de manière significative, comme le montre le modèle de souris nude BALB / c xénogreffé Hs38.T (99).
Une autre étude récente a également confirmé les effets de l'hydrogène gazeux dans la suppression du glioblastome (GBM), la tumeur cérébrale maligne la plus courante. Une étude in vitro a indiqué que l'hydrogène gazeux inhibait plusieurs marqueurs impliqués dans la souche, entraînant la suppression de la formation de sphères, la migration cellulaire, l'invasion et la formation de colonies de cellules de gliome. En inhalant de l'hydrogène gazeux (67%) 1 h, 2 fois par jour, la croissance du GBM a été significativement inhibée et le taux de survie a été amélioré dans un modèle de gliome orthotopique de rat, suggérant que l'hydrogène pourrait être un agent prometteur dans le traitement du GBM ( 100)
Discussion (conclusion)
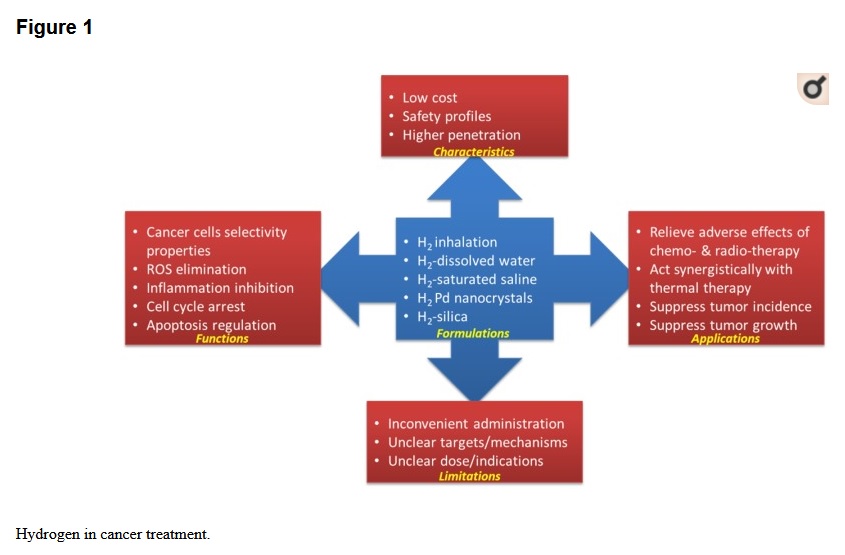
L'hydrogène gazeux a été reconnu comme un gaz médical ayant un potentiel dans le traitement des maladies cardiovasculaires, des maladies inflammatoires, des troubles neurodégénératifs et du cancer (17, 60). En tant que piégeur de radicaux hydroxyle et de peroxynitrite, et en raison de ses effets anti-inflammatoires, l'hydrogène gazeux peut agir pour prévenir / soulager les effets indésirables causés par la chimiothérapie et la radiothérapie sans compromettre leur potentiel anticancéreux (comme résumé dans le tableau 1 et la figure 1) . L'hydrogène gazeux peut également fonctionner seul ou en synergie avec une autre thérapie pour supprimer la croissance tumorale en induisant l'apoptose, en inhibant les facteurs liés aux CSC et au cycle cellulaire, etc. (résumés dans le tableau 1).